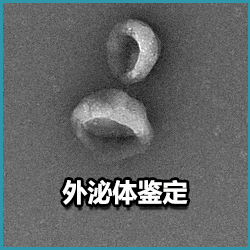
外泌体(Exosomes)产生于细胞中的多泡体,是活细胞分泌的直径约为30~150 nm 的膜性囊泡,密度为 1.13-1.19 g/ml,有典型的“杯盘”形态。人体中几乎所有类型的细胞均能产生外泌体,近乎于平均每个人体细胞产生 1000-10000 个。
通常 1ml 血液中存在 1×10^12 个外泌体。外泌体具有异质性,即使是同一种细胞分泌的外泌体都有可能具有很大功能区别。外泌体几乎存在于所有的组织、细胞间隙、体液中,包括血液、唾液、尿液和母乳。外泌体携带了参与细胞内信号转导的蛋白、 miRNA、 lncRNA、 circRNA、 mRNA 以及其降解片段,参与细胞活动的重要调控;在肿瘤转移、免疫调控机制、疾病发生发展、阿兹海默症和免疫疾病等疑难杂症的治疗方面崭露头角,有望成为多种疾病的早期诊断标志物。
外泌体的分离方法主要有:差速离心、密度梯度离心、体积排阻色谱法、过滤法、聚合物沉淀法、免疫分离、隔离筛选法等。但是 CNS 上外泌体研究的文献中主流的分离方法目前还是超速离心的方法。超速离心分离可以准确地重复获取外泌体,同时最大限度减少蛋白质聚集体和其他膜粒子的共纯化。
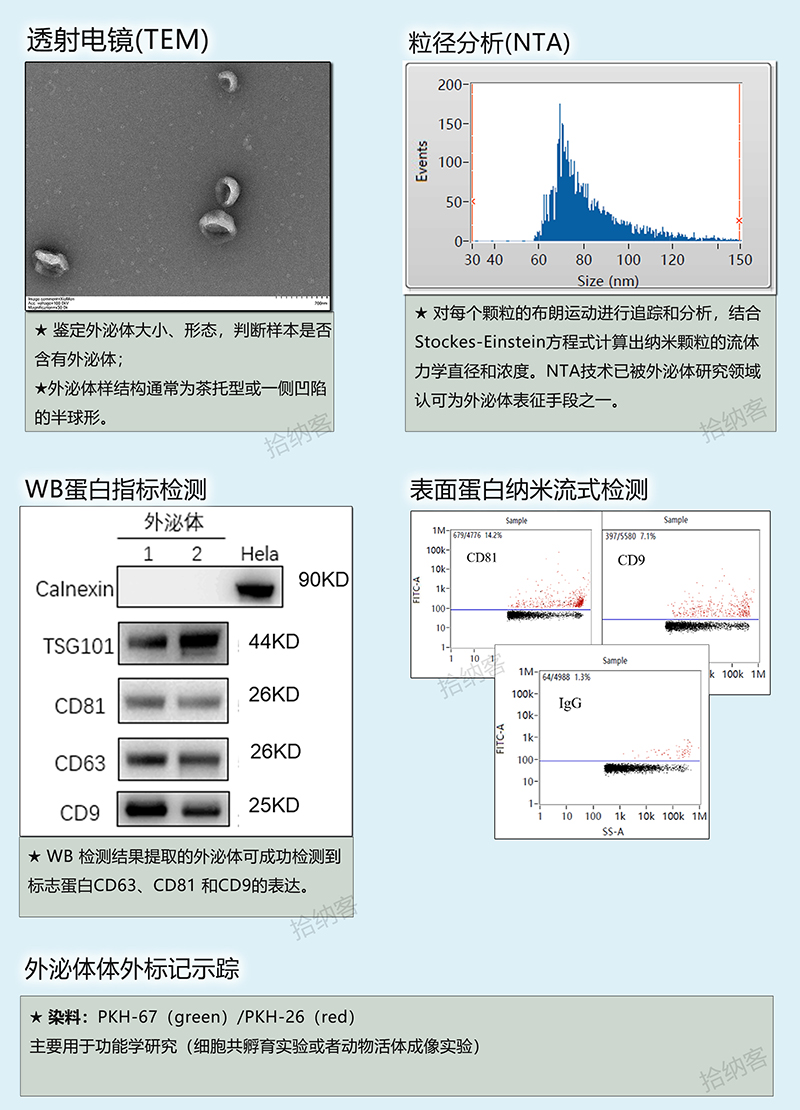
目前我公司对于外泌体的鉴定方法主要有:透射电子显微镜(TEM)、粒径分析(NTA 或 NanoFCM) 、蛋白指标检测(Western Blot 或 NanoFCM) 等,详细如下表: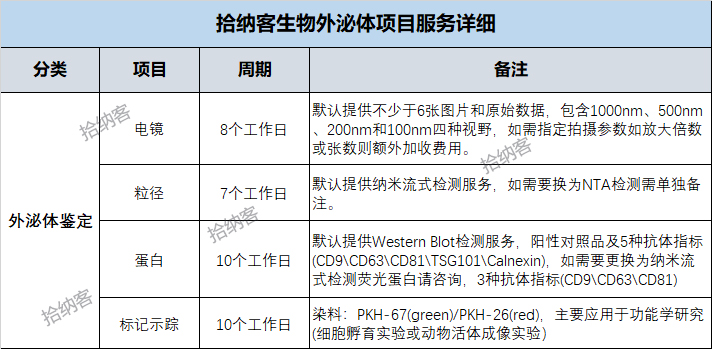
各类型样品收样量要求: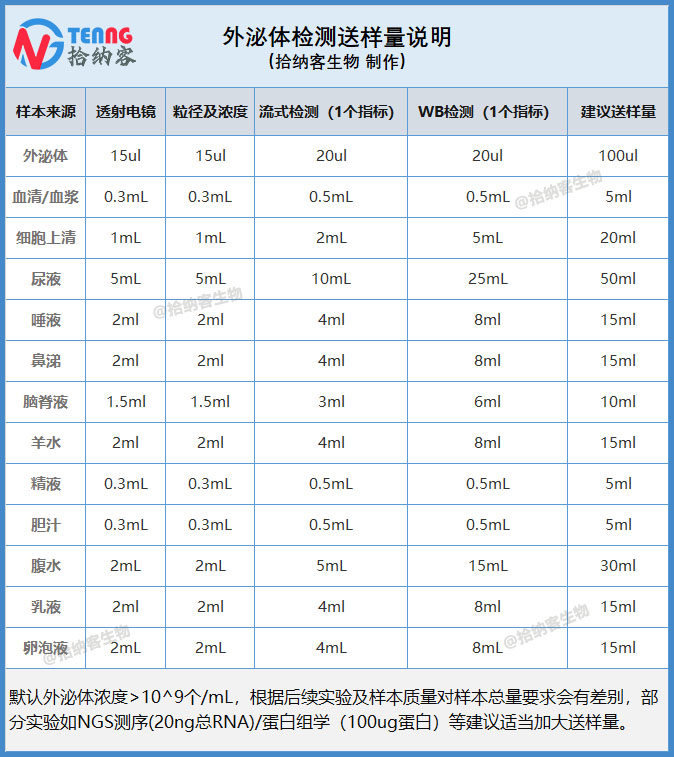
结果示意图:![]()
观察标记PHK2.6(RED)外泌体在BMSC细胞内的摄取示例: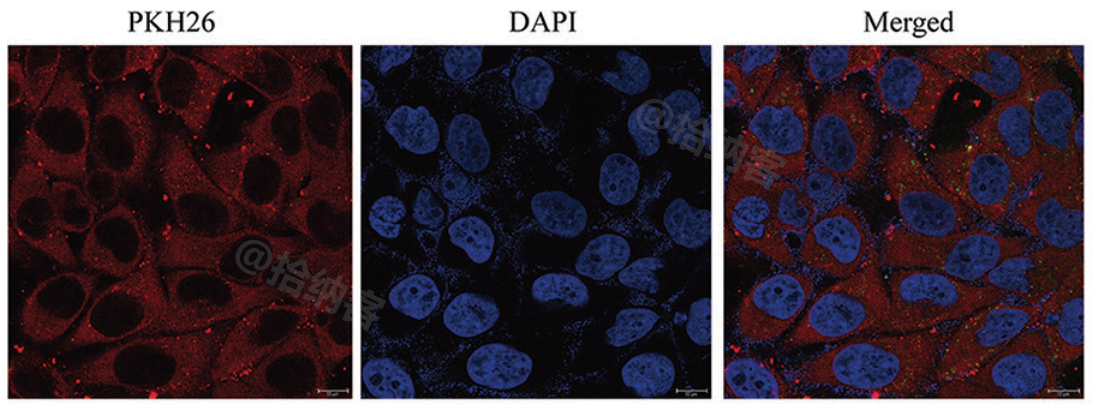

注意事项:
● 采集的样本需要符合纳入标准:如年龄、肥胖(身高、体重)、血糖血脂血压、诊断情况等。
● 统一早晨空腹采血,尽量避免样本间的差异影响。
● 如个别样本发生溶血,则弃掉。
● 样本编号用油性笔清楚地写在管壁及管盖上。
● 离心管在放入冰箱前,用封口膜密封。
● 如果提供的是冻存细胞株,需提供详尽的复苏方法。
● 细胞培养基必须使用去除exosome(de-exosome)的血清或者无血清培养基(例如Thermo Fisher的SFM)。
● 分离外泌体前的样品不能加入任何RNA保护剂(如Trizol)。
● 分离好的外泌体如需进行电镜观察,需要放4°C保存,并且不宜保存太久。
● 全血建议使用PAXgene管保存,不可冻融,取血后尽早制备血浆或血清,血浆或血清可以-80°C保存,但应避免反复冻融。
● 储存条件以及储存时间影响外泌体得率,保存在-80℃冰箱中的样本,如果储存时间过长,外泌体产量也会显著降低。
● 干冰运输应采用壁厚且质量完好的泡沫箱,24小时到达的,干冰数量不得低于5公斤;48小时到达的,干冰数量不得低于8公斤;夏季适当增加干冰(1.5 倍)。
常见实验问题:
1.血浆(plasma)还是血清(serum)?
对于大多数涉及到Exosome RNA分离的研究,我们推荐使用血浆(plasma)。因为血清收集后在凝血过程中,血小板受到刺激会产生许多Exosome和其他形式的小泡,因此血清中获得的小泡始终比血浆中多,甚至超过50%的小泡来源于血小板。所以血浆是研究病理生理状态下Exosome更好的介质。多数的criculating Exosome研究样本使用的是血浆。负压采血之后,血液首先存放入采血管,去除止血带,最初的几毫升不要,因为有压力激活效应,并且被成纤维细胞污染。血液收集应该轻柔并且迅速。颠倒混匀采血管8-10次,与管壁上的抗凝剂混合,但不要为了抗凝而剧烈摇动。离心前管子应该垂直存放,并记录实验室中存放的时间,因为从采血到离心除去细胞和血小板这中间的过程很重要,建议在30min内完成,长时间的存放,而没有及时处理会导致血小板细胞Exosome的进一步释放。血液要尽快处理,在室温条件下分离血浆(或者血清)。所有样品要使用相同的转速和转子类型离心。
2.怎样选择抗凝剂(anticoagulant)?
抗凝剂有一个或多个形式的功能,包括螯合钙、蛋白酶抑制和抑制血小板活化。有许多抗凝血剂可用,但不建议使用肝素(heparin)抗凝剂。无论是外源性或内源性起源(例如肥大细胞),肝素会抑制下游PCR反应,因为肝素会与引物和酶竞争与核酸结合。另外,肝素可抑制Exosome与靶细胞的结合,抑制Exosome激活血小板或降低血小板激活阈值。应用肝素治疗的病人也应该注意。 对于珍贵样本,可能需要从肝素化的血液样品中提取RNA。核酸的检测需要通过调整PCR的敏感性。另外如果Exosome相关核酸被发现只存在于Exosome内,在RNA分离之前的洗涤也可以帮助去除肝素。其它抗凝剂如EDTA、氟化钠/草酸钾(NaF/KOx),或柠檬酸三钠[加入/不加右旋糖dextrose(ACD)或茶碱(theophylline)、腺苷(adenosine)和双嘧达莫(CTAD)]就更复杂了,最好根据下游的实验来指导。CTAD阻碍血小板活化和随后的Exosome释放。EDTA可干扰PCR反应(尽管程度低于肝素),但它的存在可能是无害的。另外,下游实验的选择需要考虑到抗凝剂的使用种类。不同的聚合酶对抑制剂有不同的敏感性。
3.静脉取血过程应该注意什么?
在血液处理过程中,由于物理作用力,血小板中的Exosome容易在处理过程中释放,这些外力包括:接触、压力、剪切力,所以标准化的样品处理,需要统一的注射器型号以及其他操作。使用21号针头或者更大号的针头可以避免静脉取血剪切力引起的不良效应。负压采血之后,血液首先存放入采血管,去除止血带,最初的几毫升不要,因为有压力激活效应,并且被成纤维细胞污染。血液收集应该轻柔并且迅速颠倒混匀采血管8-10次,与管壁上的抗凝剂混合,但不要为了抗凝而剧烈摇动。
4.样本受昼夜节律,采血时间和饮食状态的影响吗?
血液学参数在人体的一天之中是有变化的,血液粘稠度的轻微变化在几十年前就已发现。最近发现,昼夜节律对于血小板的激活具有很大的影响,而且比压力(包括锻炼身体)的影响还要大。 白细胞穿梭以及在促炎症因子和抗炎症因子在血液循环中存在也在一天当中有变化。因此,对于Exosome的研究,在实验设计上,需要有严格的对照,采血时间在昼夜节律上的一致才能更容易的比较样本差异。此外,还需要考虑,样本来源人体在正常睡眠/苏醒周期上的差异性。食物对于Exosome的影响目前还不知道,但是因为脂蛋白载着RNA,食物的吸收影响血液循环中脂蛋白颗粒的类型、数量和功能,因此采血可以在饭后一个统一的时间点进行,进食记录也是很有价值的。
5.还需要额外的数据收集吗?
来自血液其他数据对于分析病理生理作用也是很有意义的,有时可能还需要分离其它细胞如白细胞或者血清游离DNA/RNA作为Exosome的对照,有时需要流式细胞术配合抗体对细胞分选或分析,确定血液细胞组分的比例。血中Exosome可能来自其他组织器官,有时需要从同一个患者身上得到多种体液与血液进行对比,例如脑脊液(CSF)和血浆样本。
6.溶血是否影响结果?
一般溶血样本通过颜色就可以看出来,如果必要可通过分光光度计和血红蛋白释放实验测量。当分析总exRNA,溶血的血液制品含有高浓度的特定RNA,其中包括miR-16和miR-451等,还有待确定RNA以这种方式释放是否会干扰exRNA分析结果。
7.血液样本需要记录哪些信息?
国际细胞外囊泡学会(International Society for Extracellular Vesicles, ISEV)推荐记录如下信息:
采血时间
采血针的类型/其他配件
抗凝管的类型
起始弃去的血液有多少?止血带是否移除迅速?
采血时间和离心时间间隔有多久?
处理注意事项(样本是否保持垂直?是否室温存放?)
是否溶血和检测方法?
样本处理细节(转子类型、离心力、离心时间)
样本分装细节和存放
细胞是否分离?
全血计数?
流式检测?
是否还进行其他血液检测?
是否有匹配的其他样本收集(比如血浆和血清,尿液,鼻液,口水等)
是否有病人亲属样本作为对照
常见样本问题:
1、分离方法适用于哪些种类样品中的外泌体提取?
可用于细胞上清液、血清、血浆、尿液及其他低密度体液(如脑脊液、腹水、羊水、乳汁、唾液等)的外泌体提取。
2、样品在提取外泌体之前是否可以低温保存?
可以。血样、尿样、体液等,需要攒齐了一起提取,或者同一个患者的样本多次提取。冻存前,首先要离心去除细胞和血小板,再将样品分装冻存于-20或-80℃。但如果有条件最好还是用新鲜样品立即进行提取。长期请保存于-80℃,无须加冻存液;短期(1-2天内)则保存于4℃即可。
3、外泌体提取后是否可以冻存?
可以。使用硅化E.P.管或冻存管,减少exosome的粘附。Exosome能够承受反复冻融,建议分装,避免多次反复冻融。对于一些功能性实验,建议不要冻存,直接使用新鲜提取或保存在4℃悬浮于PBS 中的exosome。4℃保存不超过一周,-80℃条件下可长期保存。
4、需要从血浆中分离外泌体,可以使用肝素或EDTA管去收集血液样本吗?
不可以。肝素将会大大损害接下来的RNA实验。EDTA也许会干扰PCR 实验。使用无肝素无EDTA管去收集血液样本。立即离心样品收集血浆用于exosome分离。如果必须使用抗凝剂,用EDTA管收集血液。如果有必要的话在接下来的PCR反应中调整Mg++的浓度。采血管的选择:血浆(plasma):紫盖采血管;血清(serum):黄盖采血管(促凝管或促凝管带分离胶)。
5、粘度过大的样品如何处理?
如果样品粘度过大时(因细胞分泌物较多所致),可将样品用1×PBS缓冲液进行等体积稀释。
6、培养细胞时,如何去除血清来源的外泌体?
多数情况下,细胞在体外培时养需要血清,而血清中一般都含有外泌体,为避免血清对细胞外泌体的污染,可采用以下两种方法:
(1)将细胞培养用的血清通过1×105g超速离心10h以去除血清外泌体;
(2)选择无血清培养基进行细胞培养。
7、无外泌体血清培养基(或者无血清培养基)在什么时候使用?
细胞在正常含血清的培养基中培养一定的时间后,细胞融合度约为60%-70%时,移去原有含血清的培养基,换成新鲜的无外泌体血清培养基(或者无血清培养基),继续培养24-48h,细胞融合度达到80%-95%左右时收取上清,该上清液即可用于提取外泌体。
8、细胞培养过程中的死细胞是否会影响外泌体的提取?
会的。在收获细胞时,应确定死亡细胞占比不超过5%。细胞凋亡/死亡过程中会释放大量大小不等的囊泡,它们在外泌体的提取纯化过程中会污染活细胞产生的外泌体。
9、如何鉴定提取的外泌体?
通常使用透射电镜检测(形态)、粒径检测(大小)、Western blot检测等方法鉴定提取的外泌体。在进行Western blot检测时,通常检测外泌体标志蛋白(CD63、CD9、CD81、TSG101等),按照国际细胞外囊泡协会的建议为检测2个阳性和1个阴性指标。
10、准备做细胞外泌体Small RNA的NGS测序,初始样品量需要准备多少?
普通肿瘤细胞系推荐使用40mL以上的初始样品量。由于某些细胞(如悬浮细胞、干细胞、神经细胞等)中外泌体含量比较低,建议先通过10kD超滤柱浓缩,准备40mL以上的浓缩液再进行超速离心分离外泌体,一般需提取到20ng以上的Total RNA。
11、进行外泌体RNA RT-PCR实验推荐什么内参?
取决于具体样品,可以选择外源添加cel-miR-39-3p,或内源U6、SNORD61、SNORD68、SNORD72作为内参。
12、提取的外泌体进行Western blot前是否需要加入RIPA试剂裂解?
需要,一般按照1:1的比例加入RIPA试剂。
13、进行外泌体Western blot鉴定时有无内参蛋白可供选择?
无,该检测属于定性检测。
14、组织细胞外泌体如何提取?
无菌环境下将组织剪成小块(越小越好),然后在无血清的培养基中培养12h;将培养液转移至离心管中,于4℃以3000g离心20 min去除培养液中杂质和细胞碎片,将上清液转移至新的离心管中;先使用0.45μm滤器过滤上清液,接着使用0.2μm滤器过滤上清液,再进行超速离心分离外泌体。有条件的话建议采用Transwell小室培养的方式,效果更佳。
外泌体(Exosomes)产生于细胞中的多泡体,是活细胞分泌的直径约为30~150 nm 的膜性囊泡,密度为 1.13-1.19 g/ml,有典型的“杯盘”形态。人体中几乎所有类型的细胞均能产生外泌体,近乎于平均每个人体细胞产生 1000-10000 个。
通常 1ml 血液中存在 1×10^12 个外泌体。外泌体具有异质性,即使是同一种细胞分泌的外泌体都有可能具有很大功能区别。外泌体几乎存在于所有的组织、细胞间隙、体液中,包括血液、唾液、尿液和母乳。外泌体携带了参与细胞内信号转导的蛋白、 miRNA、 lncRNA、 circRNA、 mRNA 以及其降解片段,参与细胞活动的重要调控;在肿瘤转移、免疫调控机制、疾病发生发展、阿兹海默症和免疫疾病等疑难杂症的治疗方面崭露头角,有望成为多种疾病的早期诊断标志物。
外泌体的分离方法主要有:差速离心、密度梯度离心、体积排阻色谱法、过滤法、聚合物沉淀法、免疫分离、隔离筛选法等。但是 CNS 上外泌体研究的文献中主流的分离方法目前还是超速离心的方法。超速离心分离可以准确地重复获取外泌体,同时最大限度减少蛋白质聚集体和其他膜粒子的共纯化。
目前我公司对于外泌体的鉴定方法主要有:透射电子显微镜(TEM)、粒径分析(NTA 或 NanoFCM) 、蛋白指标检测(Western Blot 或 NanoFCM) 等,详细如下表:
各类型样品收样量要求:
结果示意图:![]()

观察标记PHK2.6(RED)外泌体在BMSC细胞内的摄取示例:

注意事项:
● 采集的样本需要符合纳入标准:如年龄、肥胖(身高、体重)、血糖血脂血压、诊断情况等。
● 统一早晨空腹采血,尽量避免样本间的差异影响。
● 如个别样本发生溶血,则弃掉。
● 样本编号用油性笔清楚地写在管壁及管盖上。
● 离心管在放入冰箱前,用封口膜密封。
● 如果提供的是冻存细胞株,需提供详尽的复苏方法。
● 细胞培养基必须使用去除exosome(de-exosome)的血清或者无血清培养基(例如Thermo Fisher的SFM)。
● 分离外泌体前的样品不能加入任何RNA保护剂(如Trizol)。
● 分离好的外泌体如需进行电镜观察,需要放4°C保存,并且不宜保存太久。
● 全血建议使用PAXgene管保存,不可冻融,取血后尽早制备血浆或血清,血浆或血清可以-80°C保存,但应避免反复冻融。
● 储存条件以及储存时间影响外泌体得率,保存在-80℃冰箱中的样本,如果储存时间过长,外泌体产量也会显著降低。
● 干冰运输应采用壁厚且质量完好的泡沫箱,24小时到达的,干冰数量不得低于5公斤;48小时到达的,干冰数量不得低于8公斤;夏季适当增加干冰(1.5 倍)。
常见实验问题:
1.血浆(plasma)还是血清(serum)?
对于大多数涉及到Exosome RNA分离的研究,我们推荐使用血浆(plasma)。因为血清收集后在凝血过程中,血小板受到刺激会产生许多Exosome和其他形式的小泡,因此血清中获得的小泡始终比血浆中多,甚至超过50%的小泡来源于血小板。所以血浆是研究病理生理状态下Exosome更好的介质。多数的criculating Exosome研究样本使用的是血浆。负压采血之后,血液首先存放入采血管,去除止血带,最初的几毫升不要,因为有压力激活效应,并且被成纤维细胞污染。血液收集应该轻柔并且迅速。颠倒混匀采血管8-10次,与管壁上的抗凝剂混合,但不要为了抗凝而剧烈摇动。离心前管子应该垂直存放,并记录实验室中存放的时间,因为从采血到离心除去细胞和血小板这中间的过程很重要,建议在30min内完成,长时间的存放,而没有及时处理会导致血小板细胞Exosome的进一步释放。血液要尽快处理,在室温条件下分离血浆(或者血清)。所有样品要使用相同的转速和转子类型离心。
2.怎样选择抗凝剂(anticoagulant)?
抗凝剂有一个或多个形式的功能,包括螯合钙、蛋白酶抑制和抑制血小板活化。有许多抗凝血剂可用,但不建议使用肝素(heparin)抗凝剂。无论是外源性或内源性起源(例如肥大细胞),肝素会抑制下游PCR反应,因为肝素会与引物和酶竞争与核酸结合。另外,肝素可抑制Exosome与靶细胞的结合,抑制Exosome激活血小板或降低血小板激活阈值。应用肝素治疗的病人也应该注意。 对于珍贵样本,可能需要从肝素化的血液样品中提取RNA。核酸的检测需要通过调整PCR的敏感性。另外如果Exosome相关核酸被发现只存在于Exosome内,在RNA分离之前的洗涤也可以帮助去除肝素。其它抗凝剂如EDTA、氟化钠/草酸钾(NaF/KOx),或柠檬酸三钠[加入/不加右旋糖dextrose(ACD)或茶碱(theophylline)、腺苷(adenosine)和双嘧达莫(CTAD)]就更复杂了,最好根据下游的实验来指导。CTAD阻碍血小板活化和随后的Exosome释放。EDTA可干扰PCR反应(尽管程度低于肝素),但它的存在可能是无害的。另外,下游实验的选择需要考虑到抗凝剂的使用种类。不同的聚合酶对抑制剂有不同的敏感性。
3.静脉取血过程应该注意什么?
在血液处理过程中,由于物理作用力,血小板中的Exosome容易在处理过程中释放,这些外力包括:接触、压力、剪切力,所以标准化的样品处理,需要统一的注射器型号以及其他操作。使用21号针头或者更大号的针头可以避免静脉取血剪切力引起的不良效应。负压采血之后,血液首先存放入采血管,去除止血带,最初的几毫升不要,因为有压力激活效应,并且被成纤维细胞污染。血液收集应该轻柔并且迅速颠倒混匀采血管8-10次,与管壁上的抗凝剂混合,但不要为了抗凝而剧烈摇动。
4.样本受昼夜节律,采血时间和饮食状态的影响吗?
血液学参数在人体的一天之中是有变化的,血液粘稠度的轻微变化在几十年前就已发现。最近发现,昼夜节律对于血小板的激活具有很大的影响,而且比压力(包括锻炼身体)的影响还要大。 白细胞穿梭以及在促炎症因子和抗炎症因子在血液循环中存在也在一天当中有变化。因此,对于Exosome的研究,在实验设计上,需要有严格的对照,采血时间在昼夜节律上的一致才能更容易的比较样本差异。此外,还需要考虑,样本来源人体在正常睡眠/苏醒周期上的差异性。食物对于Exosome的影响目前还不知道,但是因为脂蛋白载着RNA,食物的吸收影响血液循环中脂蛋白颗粒的类型、数量和功能,因此采血可以在饭后一个统一的时间点进行,进食记录也是很有价值的。
5.还需要额外的数据收集吗?
来自血液其他数据对于分析病理生理作用也是很有意义的,有时可能还需要分离其它细胞如白细胞或者血清游离DNA/RNA作为Exosome的对照,有时需要流式细胞术配合抗体对细胞分选或分析,确定血液细胞组分的比例。血中Exosome可能来自其他组织器官,有时需要从同一个患者身上得到多种体液与血液进行对比,例如脑脊液(CSF)和血浆样本。
6.溶血是否影响结果?
一般溶血样本通过颜色就可以看出来,如果必要可通过分光光度计和血红蛋白释放实验测量。当分析总exRNA,溶血的血液制品含有高浓度的特定RNA,其中包括miR-16和miR-451等,还有待确定RNA以这种方式释放是否会干扰exRNA分析结果。
7.血液样本需要记录哪些信息?
国际细胞外囊泡学会(International Society for Extracellular Vesicles, ISEV)推荐记录如下信息:
采血时间
采血针的类型/其他配件
抗凝管的类型
起始弃去的血液有多少?止血带是否移除迅速?
采血时间和离心时间间隔有多久?
处理注意事项(样本是否保持垂直?是否室温存放?)
是否溶血和检测方法?
样本处理细节(转子类型、离心力、离心时间)
样本分装细节和存放
细胞是否分离?
全血计数?
流式检测?
是否还进行其他血液检测?
是否有匹配的其他样本收集(比如血浆和血清,尿液,鼻液,口水等)
是否有病人亲属样本作为对照
常见样本问题:
1、分离方法适用于哪些种类样品中的外泌体提取?
可用于细胞上清液、血清、血浆、尿液及其他低密度体液(如脑脊液、腹水、羊水、乳汁、唾液等)的外泌体提取。
2、样品在提取外泌体之前是否可以低温保存?
可以。血样、尿样、体液等,需要攒齐了一起提取,或者同一个患者的样本多次提取。冻存前,首先要离心去除细胞和血小板,再将样品分装冻存于-20或-80℃。但如果有条件最好还是用新鲜样品立即进行提取。长期请保存于-80℃,无须加冻存液;短期(1-2天内)则保存于4℃即可。
3、外泌体提取后是否可以冻存?
可以。使用硅化E.P.管或冻存管,减少exosome的粘附。Exosome能够承受反复冻融,建议分装,避免多次反复冻融。对于一些功能性实验,建议不要冻存,直接使用新鲜提取或保存在4℃悬浮于PBS 中的exosome。4℃保存不超过一周,-80℃条件下可长期保存。
4、需要从血浆中分离外泌体,可以使用肝素或EDTA管去收集血液样本吗?
不可以。肝素将会大大损害接下来的RNA实验。EDTA也许会干扰PCR 实验。使用无肝素无EDTA管去收集血液样本。立即离心样品收集血浆用于exosome分离。如果必须使用抗凝剂,用EDTA管收集血液。如果有必要的话在接下来的PCR反应中调整Mg++的浓度。采血管的选择:血浆(plasma):紫盖采血管;血清(serum):黄盖采血管(促凝管或促凝管带分离胶)。
5、粘度过大的样品如何处理?
如果样品粘度过大时(因细胞分泌物较多所致),可将样品用1×PBS缓冲液进行等体积稀释。
6、培养细胞时,如何去除血清来源的外泌体?
多数情况下,细胞在体外培时养需要血清,而血清中一般都含有外泌体,为避免血清对细胞外泌体的污染,可采用以下两种方法:
(1)将细胞培养用的血清通过1×105g超速离心10h以去除血清外泌体;
(2)选择无血清培养基进行细胞培养。
7、无外泌体血清培养基(或者无血清培养基)在什么时候使用?
细胞在正常含血清的培养基中培养一定的时间后,细胞融合度约为60%-70%时,移去原有含血清的培养基,换成新鲜的无外泌体血清培养基(或者无血清培养基),继续培养24-48h,细胞融合度达到80%-95%左右时收取上清,该上清液即可用于提取外泌体。
8、细胞培养过程中的死细胞是否会影响外泌体的提取?
会的。在收获细胞时,应确定死亡细胞占比不超过5%。细胞凋亡/死亡过程中会释放大量大小不等的囊泡,它们在外泌体的提取纯化过程中会污染活细胞产生的外泌体。
9、如何鉴定提取的外泌体?
通常使用透射电镜检测(形态)、粒径检测(大小)、Western blot检测等方法鉴定提取的外泌体。在进行Western blot检测时,通常检测外泌体标志蛋白(CD63、CD9、CD81、TSG101等),按照国际细胞外囊泡协会的建议为检测2个阳性和1个阴性指标。
10、准备做细胞外泌体Small RNA的NGS测序,初始样品量需要准备多少?
普通肿瘤细胞系推荐使用40mL以上的初始样品量。由于某些细胞(如悬浮细胞、干细胞、神经细胞等)中外泌体含量比较低,建议先通过10kD超滤柱浓缩,准备40mL以上的浓缩液再进行超速离心分离外泌体,一般需提取到20ng以上的Total RNA。
11、进行外泌体RNA RT-PCR实验推荐什么内参?
取决于具体样品,可以选择外源添加cel-miR-39-3p,或内源U6、SNORD61、SNORD68、SNORD72作为内参。
12、提取的外泌体进行Western blot前是否需要加入RIPA试剂裂解?
需要,一般按照1:1的比例加入RIPA试剂。
13、进行外泌体Western blot鉴定时有无内参蛋白可供选择?
无,该检测属于定性检测。
14、组织细胞外泌体如何提取?
无菌环境下将组织剪成小块(越小越好),然后在无血清的培养基中培养12h;将培养液转移至离心管中,于4℃以3000g离心20 min去除培养液中杂质和细胞碎片,将上清液转移至新的离心管中;先使用0.45μm滤器过滤上清液,接着使用0.2μm滤器过滤上清液,再进行超速离心分离外泌体。有条件的话建议采用Transwell小室培养的方式,效果更佳。
 中文
中文